Theo nội dung thông báo được ký ngày 30/7, lý do Công ty Cổ phần Dược phẩm Me Di Sun bị ngừng tiếp nhận hồ sơ đề nghị cấp, gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc là công ty này đã có hành vi sản xuất 2 lô thuốc vi phạm chất lượng mức độ 2.
Thời gian thực hiện việc ngừng tiếp nhận hồ sơ là 12 tháng, kể từ ngày 30/7/2025. Khi hết thời hạn, công ty muốn đăng ký thuốc, nguyên liệu làm thuốc phải nộp hồ sơ theo quy định.
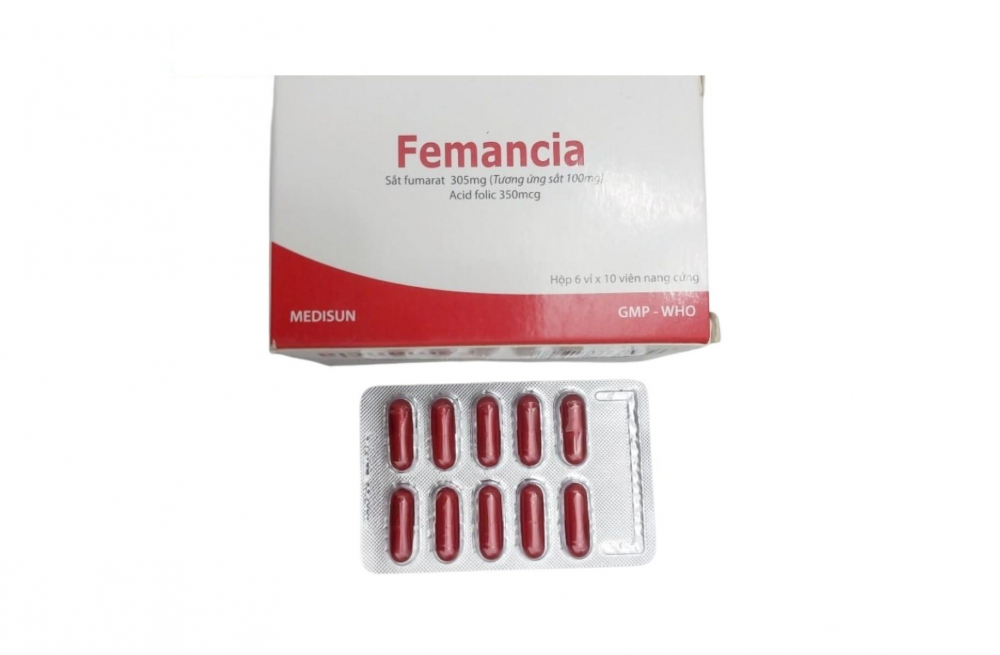
Trước đó, vào tháng 3, Cục Quản lý Dược thông báo thu hồi hai lô thuốc Viên nang cứng Femancia (Sắt nguyên tố (dưới dạng Sắt fumarat 305 mg) 100 mg; Acid Folic 350 mcg), có số đăng ký lưu hành VD-27929-17, do Công ty Cổ phần Dược phẩm Me Di Sun (TPHCM) đứng tên.
2 lô gồm: Lô số 031222, ngày sản xuất 2/12/2022, hạn dùng 2/12/2025 và lô số 020223, ngày sản xuất 21/2/2023, hạn dùng 21/2/2026. Các lô này bị phát hiện không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng, độ hòa tan, vi phạm mức độ 2.
Giữa tháng 7, cơ quan quản lý về lĩnh vực dược thuộc Bộ Y tế cũng thông báo thu hồi giấy đăng ký lưu hành thuốc tại Việt Nam đối với thuốc Femancia - loại thuốc uống bổ sung sắt, ngăn ngừa tình trạng thiếu máu thiếu sắt. Khi đó, Cục Quản lý Dược cho biết thuốc Femanica sẽ không được sản xuất và lưu hành trên thị trường kể từ ngày 16/7. Công ty Cổ phần Dược phẩm Me Di Sun phải thực hiện thu hồi thuốc nêu trên theo quy định.














